
電話:
021-67610176傳真:
GST融合蛋白純化篇
1.如何純化GST融合蛋白?
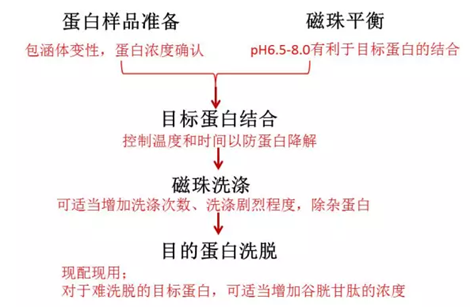
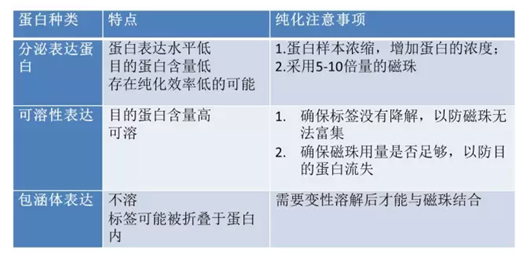
2.可純化蛋白種類
3.磁珠掛不上目的蛋白
以下的處理方案的前提是樣本里面有目的蛋白,如果是包涵體需要變性。
可能一:結合條件不對
理想的結合條件為pH 6.5-8.0,純化之前確認磁珠是否采用緩沖液平衡以及蛋白樣本的pH值,低于pH6.5或高于pH8時,融合蛋白與磁珠結合不充分導致結合效率低。
可能二:樣本中目的蛋白的濃度偏低
目的蛋白的濃度過低,會嚴重影響磁珠與蛋白的結合。
兩種方法可供選擇:
a)濃縮蛋白樣本;b)增加磁珠的濃度
可能三:檢查目的蛋白是否聚集沉淀
在細胞裂解前加入DTT,在緩沖液中也加入DTT 。1-20mM的DTT 會顯著增加某些GST融合蛋白的結合。
可能四:判斷是否是因為GST失活
過度超聲會破壞標簽蛋白而減少其與磁珠的結合。減少超聲破碎的時間和強度。
可能五:標簽蛋白可能改變了GST 構相
降低結合的溫度來改善結果。
4.目的蛋白在磁珠上,洗脫不下來
*步:判斷是否結合
取Mag beads加loading buffe煮沸,再跑page電泳。
如果確認有蛋白,且載量還很高,那么極有可能是形成了過蛋白沉積。
太多的蛋白沉積在磁珠孔內,無法洗脫。建議將目的蛋白樣本稀釋,少量純化。
第二步:調節洗脫條件
洗脫緩沖液pH,酸性的都洗不下蛋白。盡量將洗脫液的pH值調到8.0。
5.洗脫樣本里面有雜蛋白
可能一:非特異性吸附
提高平衡緩沖液中的鹽濃度可以降低因為離子作用帶來的非特異吸附。
在平衡緩沖液中添加0.5%吐溫或Triton可以避免因為疏水相互作用導致非特異吸附,這些措施都可以電泳的雜帶明顯減少。
可能二:26KD的GST條帶
GST融合蛋白的表達系統很容易表達到GST部分就終止,所以26KD左右的雜帶是很常見的,那可以選擇用不同濃度的還原谷胱甘肽去做階段洗脫,如果還是分不開,那也許就得選擇離子交換或者凝膠過濾等別的分離手段。
可能三:蛋白降解
如果用上述方法還是雜帶多,那就地回頭去看看破碎的條件是不是太劇烈或者溫度控制不好導致蛋白短裂或者分解導致一些蛋白片段帶標簽,或者因為樣品長時間保存導致水解等
可能四:蛋白相互作用
蛋白相互作用形成聚合體,導致雜帶增加,而由于疏水相互作用或者因為離子作用可以通過添加表面活性劑或者增加離子強度得到改善,對于因為形成聚合體的可以在緩沖液和樣品中加1-2mM巰基乙醇避免。